استفاده از نشاسته اصلاحشده آنزیمی در کاغذ
مروری بر آهارزنی سطحی کاغذ با نشاسته اصلاح شده با آنزیم: آهارزنی کاغذ عموماً استفاده از مواد آبگریز برای اصلاح رفتار اجزای تشکیلدهنده ماده بهمنظور بهبود ویژگیهای فیزیکی و مکانیکی است. نشاسته بهدلیل ارزانبودن و زیستتخریبپذیر بودن یکی از مهمترین موادی است که برای این منظور استفاده میشود. در این مطالعه اصلاح نشاسته با توجه به نوع کاربرد آن با روشهای شیمیایی، فیزیکی و آنزیمی مورد بررسی قرار گرفتهاند. سپس روشهای اصلاح نشاسته شیمیایی، فیزیکی و آنزیمی آهارزنی کاغذ معرفی شده است. در پایان نیز اصلاح آنزیمی نشاسته با α-آمیلاز برای کاغذسازی، مزایا و محدودیتهای نشاسته آنزیمی با α-آمیلاز در مقایسه با نشاسته کاتیونی، پرمصرفترین نوع نشاسته برای آهار سطحی کاغذ، پرداخته شد. بهطور کلی استفاده از نشاسته خام ضمن اصلاح آنزیمی در محل مصرف در صنایع کاغذسازی، بهدلیل امکان کنترل گرانروی نشاسته آمادهشده برای مصرف، قیمت کمتر مجموع نشاسته خام، α-آمیلاز مصرفی و هزینه تبدیل، عدم تشکیل ترکیبات آلی هالوژن دار (AOX) متداول در اصلاح اکسیدی نشاسته و عدم نیاز به مصرف مواد شیمیایی جانبی برای اصلاح و مصرف، استفاده از نشاسته اصلاحشده آنزیمی در کاغذ در صنایع کاغذسازی کشورهای توسعه یافته بر انواع دیگر ارجحیت دارد. بنابراین به صنایع و محققان کاغذسازی کشور نیز پیشنهاد میشود این اصلاحات را مورد بررسی قرار دهند.
پژمان رضایتی چرانی*1، احمد عزیزی موصلو2، سونیا کلانتری چروده3
1استادیار گروه مهندسی صنایع سلولزی، دانشکده منابع طبیعی، دانشگاه صنعتی خاتمالانبیاء بهبهان، ایران
*نویسنده مسئول: تلفن همراه: 09111851546، تلفکس: 06152731662، ایمیل: rezayati@bkatu.ac.ir
2 استادیار گروه مهندسی صنایع سلولزی، دانشکده منابع طبیعی، دانشگاه صنعتی خاتمالانبیاء بهبهان، ایران
تلفن همراه: 09177917723، تلفکس: 06152731662، ایمیل: azizi1353@gmail.com
3 دانشآموخته کارشناسی ارشد گروه مهندسی صنایع سلولزی، دانشکده منابع طبیعی، دانشگاه صنعتی خاتمالانبیاء بهبهان، ایران، تلفن همراه: 09397948146، تلفکس: 06152731662، ایمیل: sonia1.kalantri@gmail.com
مقدمه
آهارزنی کاغذ
آهارزنی عموماً به استفاده از مواد آبگریز برای اصلاح رفتار اجزای تشکیلدهنده ماده بهمنظور بهبود خواص فیزیکی مشخص آن است که به دو صورت آهارزنی سطحی و آهارزنی داخلی انجام میشود. مواد شیمیایی در پرس آهارزنی نسبت به مواد شیمیایی در پایانه تر، برای اثر بر اتصال بین الیاف، معمولاً تاثیری ندارند، زیرا واکنشهای بین مواد شیمیایی و الیاف قبل از پرس آهارزنی تکمیل شده است. آهارزنی سطحی که نوعی پوششدهی نیز محسوب میشود، عموماً توسط نشاسته همراه با مواد شیمیایی دیگر مثل پراکسید هیدروژن، هیپوکلریت سدیم، بوراکس و یا همراه آنزیم از طریق پخت انجام میشود (Bajpai, 2018). آهارزنی سطحی ویژگیهای اجزای سطحی را اصلاح نموده، اثرات خیلی مشخص داشته بهطوریکه 100 درصد مواد جامد روی سطح باقی میماند و رسوبات پایانه تر کاهش مییابد که سبب افزایش طول عمر مفید پارچههای ماشین میشود که سبب کاهش آلودگی محیط زیست میگردد. در این روش آهارزنی صرفاً مواد فرار در طول مدت خشکشدن از دست میرود و حساسیت کمتری به تغییرات در پایانه تر دارد (Maurer, 2001). اثر آهارزنی سطحی اصولاً به صورت فیلم سطحی شناخته میشود که تغییر ابعاد ماده را تا حد زیادی کم میکند، این مهم وقتی که از معرفهای آهار گران قیمت مثل الکل پلیونیل، کربوکسیمتیلسلولز، و حتی چسبهای حیوانی استفاده شود، بیشتر هویدا میشود. در مقابل، آهارزنی داخلی همانند یک سیمان، ویژگی سطحی تک تک اجزای ماده را اصلاح میکند. یکی از موادی که مورد آهارزنی قرار میگیرد کاغذ است که بر حسب نیاز، آهارزنی با مواد مختلفی انجام میشود که متداولترین آن نشاسته است که در آهارزنی داخلی و سطحی استفاده میشود. نشاسته در آهارزنی سطحی با نفوذ قابلتوجه در ساختار کاغذ از طرف سطح با هدف بهبود مقاومت به ترکیدگی، موجب بهبود آهارزنی داخلی و دیگر خواص ورقه نیز میشود. آهارزنی عموماً با هدف بهبود چاپپذیری سطحی کاغذ صورت میگیرد که از طریق افزایش مقاومت به نفوذ مایعات (آب، روغن و گیریس)، استحکام سطحی، استحکام ورقه و پایداری ابعادی، و کنترل ضریب اصطکاک سطح صورت میگیرد (Véronique Planchot, 1995). بنابراین انتظار میرود استفاده از معرفهای آهارزنی سطحی کاغذ مانند نشاسته با توجه به مزایای آنها روزبهروز افزایش یابد.
نشاسته
نشاسته بهعنوان یکی از متداولترین بسپارهای زیستی در طبیعت، سومین ماده اصلی مصرفی در کاغذسازی از نظر وزنی (Maurer, 1998) و متداولترین چسب مصرفی در آهارزنی کاغذ است (Lipponen, 2005) که از بسیاری از گیاهان مثل ذرت، گندم، برنج، سیبزمینی و تاپیوکا تولید میشود (Young, 1984). این بسپار زیست سازگار و تخریبپذیر، غیرسمی، کمهزینه و قابل تجدید است (Anwunobi, 2011; Lu, 2009). نشاسته از واحد تکپار ∝-D-گلیکوزیدی تشکیل شده است که دارای دو ماده شیمیایی اصلی آمیلوز (20 تا 30 درصد وزنی) بهعنوان یک بسپار با زنجیره مستقیم با 200 تا 6000 واحد تکپار گلوکز است، و آمیلوپکتین (70 تا80 درصد وزنی) بهعنوان یک بسپار گلوکز با زنجیره شاخهدار با حدود 1000 واحد تکپار گلوکز است که نسبت بین این دو ماده شیمیایی در بین نشاستههای منابع مختلف متفاوت است (Chinga-Carrasco, 2019; Nawrath, 1995; Pérez, 2009; Tester, 2004; Tharanathan, 2005) (شکل 1).
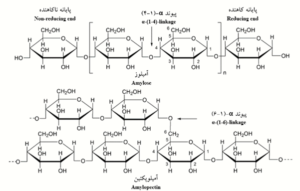
شکل1-ساختار شماتیکی شیمیایی نشاسته (Huijbrechts, 2008).
همه نشاستهها حاوی مقادیر اندکی اسید چرب، لیپد، پروتئین و نمکهای غیرآلی دیگر نیز هستند. وزن ملکولی نشاسته بهعنوان یک بسپار طبیعی زیاد است و میتواند با درجه زیادی از کنترل وابسپارش شود. نشاسته با توجه به ویژگی آبدوستی در آب با دمای محیط نامحلول است و به صورت مخلوط پخش میشود که با رسیدن دمای مخلوط به حدود 60 تا 70 درجه سانتیگراد، گرانولهای آن آب جذب نموده و متورم و در نهایت شکسته شده و منجر به کاهش وزن مولکولی و درجه کریستالی میشود. این فرایند یعنی اثر تغییرات غیرقابلبرگشت گرانولها مثل تخریب و تبدیل به ساختار نیمه کریستالی منجر به افزایش گرانروی و انحلالپذیری میشود (Bertolini, 2009) که در این حالت بهصورت ترکیب چسبنده تبدیل میشود. نشاسته ممکن است برای تولید مواد نو با ویژگیهایی که ترکیبی از مزایای بسپارهای طبیعی و مصنوعی است، پیوند خورده باشد. از عوامل مهم طرفداری از نشاسته میتوان به قیمت نسبتاً کم مواد اولیه و این حقیقت که از مواد تجدیدپذیر تهیه میشود و زیستتخریبپذیر است، میتوان اشاره نمود. همچنین استفاده از نشاسته نسبت به چسبهای حیوانی و دیگر مواد شیمیایی مثل لاتکس و الکل پلیونیل برای آهارزنی کاغذ اقتصادیتر است (Wurzburg, 1986). علیرغم این مزایا، استفاده از آن با محدودیتهایی از جمله گرانروی زیاد و حساسیت به آب و بخار آب است که لازم است مورد اصلاح قرار گیرند.
اصلاح نشاسته
عموماً نشاسه در آب سرد با دمای کمتر از 50 درجه سانتیگراد حل نمیشود و برای انحلال آن باید در حالت سوسپانسیون حرارت داده شود، در این شرایط نشاسته به صورت ژل تبدیل میشود که برای بهبود برخی از خصوصیات آن مثل پایداری گرمایی، آبگریزی، کریستالی، شفافیت و استحکام مکانیکی، نیاز به اصلاح دارد (Ojogbo, 2019). طی اصلاح، گروههای آنیونی، کاتیونی و خنثی برای تغییر بار ویژه نشاسته میتوانند به آن افزوده شوند و حتی ساختار آمیلوز و آمیلوپکتین به صورت هدفمند شکسته شود. با توجه به اینکه گروههای عاملی هیدروکسیلی نشاسته امکان دامنه گستردهای از واکنشهای اکسایشی و جانشینی را برای تنظیم خصوصیات آن از جمله تنظیم گرانروی و اجتناب از بیاتشدن (Retrogradation) – نوعی بلوریشدن قسمتهای خطی نشاسته (آمیلوز) – میدهد، در طی فرایند اصلاح نشاسته، گروههای آنیونی، کاتیونی و خنثی برای تغییر بار ویژه نشاسته میتوانند به آن افزوده شوند و حتی ساختار آمیلوز و آمیلوپکتین به صورت هدفمند شکسته شود. عموماً اصلاح نشاسته به روشهای مختلفی از جمله روش شیمیایی (Liu, 2008)، فیزیکی (Hietaniemi, 2019) و آنزیمی (Flórez, 2019) انجام میشود.
اصلاح شیمیایی نشاسته
اصلاح شیمیایی به چهار روش اصلی واکنش مواد شیمیایی با گروههای هیدروکسیل و اتصالات گلیکوزیدی نشاسته شامل استری کردن (Ye, 2019)، اتری کردن (Ibrahim, 2019)، اکسیدکردن(Pandiselvam, 2019) و برقراری پیوند عرضی (Gonenc, 2019) انجام میشود (شکل2). از بین این روشها، روش اصلاح اکسیدی در صنایع کاغذسازی بیشتر مورد علاقه است. این نوع نشاسته در طیف وسیعی از گرانروی در نقطه جوش به حالت غلیظ تا رقیق (from thick boiling to thin boiling) برای استفاده در بخش تر و هم در پرس آهارزنی سطحی مناسب است. اصلاح شیمیایی آن معمولاً در مبدأ انجام میشود و ضرورت دارد مجدداً هنگام استفاده در مقصد آمادهسازی شود، در نتیجه امکان تغییر بیشتر خصوصیات این نوع نشاسته در صنایع کاغذسازی نیست.
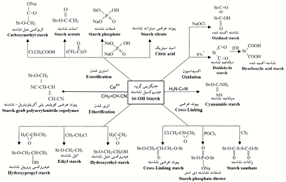
شکل 2-روشهای اصلاح شیمیایی نشاسته (Tharanathan, 2005).
اصلاح فیزیکی نشاسته
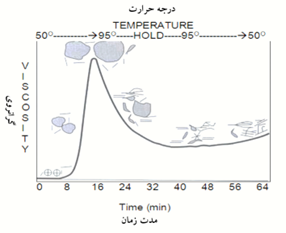
اصلاح فیزیکی معمولاً با گرم نمودن نشاسته در محیط آبی در دمای بیش از 50 درجه سانتیگراد انجام میشود (Chiu, 2009). در این شرایط گرانولهای نشاسته متورم و بعد شروع به تخریب میکنند که سبب کاهش گرانروی میشود (Chiu, 2009). اگر چه با توجه به منبع تهیه نشاسته، تغییرات گرانروی آن با تغییر دما و گذشت زمان میتواند متفاوت باشد (شکل 3). بنابراین ضرورت دارد شرایط پخت نشاسته طوری تنظیم شود که نیازمندیهای لازم برای استفاده را فراهم کند.
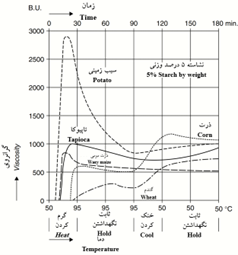
شکل 3- منحنی رفتار عمومی گرانروی نشاستههای تجارتی متداول هنگام پخت (Maurer, 2009).
آمادهسازی نشاسته به روش فیزیکی، معمولاً طی چهار مرحله صورت میگیرد (شکل 4). در مرحله نخست معمولاً نشاسته به صورت گرانول و حالت خمیری دارد. در مرحله دوم گرانولها تبدیل به رشته میشوند که حالت ژلاتینی دارند. در مرحله سوم رشتههای پلیساکارید نشاسته در آب به صورت رشتههای کوتاهتر تبدیل میشوند و آمیلاز از آمیلوپکتین جدا میشود (مرحله مایع شدن) و در مرحله چهارم رشتههای آمیلوز و آمیلوپکتین به صورت قندهای دیساکارید و منوساکارید تبدیل میشوند (تبدیل به قند شدن). در صورت استفاده از معرف ید، تغییر رنگ آن در هر یک از چهار مرحله به شرح شکل 4 است. این تغییر رنگ بهدلیل تغییر درصد رشتههای آمیلوز، که کمپلکسشان با معرف ید رنگ آبی تیره را دارند، به آمیلوپکتین است که کمپلکسشان با معرف ید بنفش تا قرمز ایجاد کند (Bates, 1943). بهعبارتی هر چقدر سهم آمیلوز بیشتر باشد (بیش از 75 درصد) رنگ محلول نشاسته به رنگ آبی تیره متمایل میشود و اگر سهم آمیلوز کمتر باشد (تقریبا بدون آمیلوز) و آمیلوپکتین بیشتر شود به بنفش تا قرمز متمایل میشود که نشاستههای مومی شکل (waxy starches) و نشاسته گلوتن از این نوع میباشند که دارای حدود 99 درصد آمیلوپکتین هستند (Chinga-Carrasco, 2019) و در صورتی که سهم آمیلوز بین 17 تا 30 درصد برسد به رنگ ارغوانی متمایل خواهد شد.
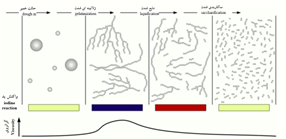
شکل 4- چهار مرحله تبدیل گرانولهای نشاسته در حالت مخلوط همراه تغییرات رنگ معرف شناساییگر ید و تغییرات گرانروی (Education, 2014).
محلولهای آماده شده نشاسته برای استفاده در حالت عادی پایدار هستند اما با گذر زمان برخی بیات شدنها در آن صورت میگیرد، بنابراین سبب تیره شدن محلول و افزایش گرانروی، و حتی برگشت به عقب یا ژلهای شدن در صورت زیاد بودن غلظت میشود. بیاتیشدن نشاسته (تقلیل کیفیت) در اسیدیته و دمای کم، حضور کاتیونهایی مشخص مثل آلومینیم یا کلسیم، و سردکردن ملایم افزایش مییابد. نمودار تغییرات وضعیت و انتقال حالت نشاسته هنگام حرارتدادن در شکل 5 نشان داده شده است. نشاسته هنگام گرمشدن از ساختار کریستالی به آمورف و مجدداً کریستالی، هنگام خنک شدن و در حین ذخیرهسازی، تبدیل میشود (TG، دمای ژلاتینهشدن؛ AM، آمیلوز؛ AP، آمیلوپکتین) انجام میشود (Schirmer, 2015).
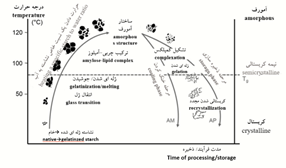
شکل5- نمودار تغییرات وضعیت و انتقال حالت نشاسته هنگام حرارت دادن(Schirmer, 2015).
اصلاح آنزیمی نشاسته
نشاسته خام برای استفاده در آهارزنی سطحی و پوششدهی کاغذ بیشتر از طریق آنزیمی با هدف دستیابی به گرانروی مناسب با شرایط فرآیندی تولید اصلاح میشود (Florez, 2019; Meimoun, 2018). این روش معمولاً توام با اصلاح فیزیکی در محیط آبی انجام میشود. برای کاربردهای کم اهمیت، ذرات خام نشاسته هنگام آمادهسازی در مقصد بهوسیله تبدیلات آنزیمی یا شیمیایی/ فیزیکی وابسپارش میشود (Bajpai, 2018).
بیشتر بخوانید: تأثیر آنزیم در آهارزنی کاغذ
آنزیمهای مورد استفاده در اصلاح نشاسته
آنزیمهای مورد استفاده برای اصلاح (تبدیل) نشاسته به چهار گروه شامل اندوآمیلازها (endoamylases)، اگزوآمیلازها (exoamylases)، آنزیمهای شاخهزدا (debranching enzymes) و انتقال دهندهها (transferases) تقسیم میشوند (شکل 6). اندوآمیلازها قادرند پیوندهای ∝-دی-(4-1) گلیکوزیدی موجود در بخش داخلی زنجیره آمیلوز یا آمیلوپکتین را بشکنند. α-آمیلاز از معروفترین این نوع محسوب میشود و در انواع مختلفی از میکروارگانیسمها مثل باکتریها یافت میشود و بر حسب منبع خود شرایط عملکردی متفاوتی دارند (Véronique Planchot, 1995). آنها بهعنوان یک دسته از آنزیمهای صنعتی حدود 25 درصد سهم بازار آنزیم را به خود اختصاص دادهاند (Rajagopalan, 2008). آنزیمهای متعلق به گروه دوم، اگزوآمیلازها، ممکن است منحصراً اتصالات ∝-دی-(4-1) گلیکوزیدی را بشکنند مثل β- آمیلاز یا هر دو نوع اتصالات ∝-دی-(4-1) گلیکوزیدی و ∝-دی-(6-1) گلیکوزیدی را بشکنند مثل آمیلوگلوکزیداز یا گلوکوآمیلاز. اگزوآمیلازها روی باقیمانده گلوکز خارجی آمیلوز یا آمیلوپکتین عمل میکنند. بنابراین محصول نهایی فقط گلوکز یا مالتو دکسترین محدود است. گروه سوم آنزیمها مربوط به آنزیمهایی است که انحصاراً اتصالات ∝-دی-(6-1) گلیکوزیدی را میشکنند مثل آیزوآمیلازها. گروه چهارم آنزیمهای اصلاحکننده نشاسته مربوط به انتقال دهندهها است که اتصال ∝-دی-(4-1) گلیکوزیدی را از یک اهداکننده میشکنند و به یک گیرنده گلیکوزیدی انتقال میدهند. آمیلازهایی مثل آمیلومالتاز و دکسترین حلقوی از این گروه محسوب میشوند. امروزه تعداد زیادی از آمیلازهای میکروبی به لحاظ تجاری در دسترس هستند و تقریباً بهطور کامل جایگزین مواد شیمیایی تجزیه آبی نشاسته در فرآوری صنعتی نشاسته شدهاند. آمیلازهای حاصل از میکروارگانیسمها دارای طیف گستردهای از کاربردهای صنعتی هستند، زیرا آنها هنگامی که با آمیلازهای حیوانی و گیاهی آماده میشوند پایداری بیشتری دارند (Tanyildizi, 2005).
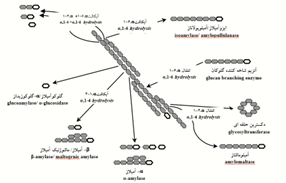
شکل6-آنزیمهای مختلفی که در تخریب نشاسته نقش دارند. ساختار حلقهباز نمادی از کاهش مولکول پلیگلوکز است (Van Der Maarel, 2002).
بیشتر آمیلازها نیاز به حالت پراکنده نشاسته برای فعالیت آنزیمی دارند، درحالیکه برخی دیگر ممکن است گرانول نشاسته را هم هضم کنند. بهعنوان مثال، α-آمیلاز دارای 21 گونه است که هر یک رفتار متفاوتی از دیگری دارد (Van Der Maarel, 2002) مثلاً گونهای که از باکتری، قارچ و جو (مالت) و پانکراس بهدست میآید که نوع حاصل از پانکراس برای تبدیل نشاسته موثرتر بوده است و در ادامه مالت، باکتری و قارچ قرار دارد (Sandstedt, 1954). پانکراس-آمیلاز بهطور موثری نشاسته گرانولشکل و نشاسته بیاتشده (Retrograded starch) را هضم میکند. α-آمیلاز حاصل از آنزیم ری آسپرجیلاس اوریزا (Aspergillus oryzae) توان کمتری برای رفتار مشابه پانکراس-آمیلاز دارد. با این حال، آنزیم آ. اوریزا برای ارزیابی مقدار پراکندگی و درجه بیاتشدن نشاسته مفید است (Tsuge,1992). متداولترین α-آمیلاز مورد استفاده از باسیلاس سوبتیلیز (Bacillus subtilis) بهدست میآید. α-آمیلاز برای استفاده در اصلاح نشاسته لازم است عاری از β-آمیلاز و گلوکو-آمیلاز باشد. آمیلازهای تجاری با توجه به توانشان با هم فرق دارند که از طریق سنجشهای آزمایشگاهی قابل ارزیابی است (Marciniak, 1982). α-آمیلازهای جدید با ویژگیهای بهینه شده مثل پایداری ابعادی ارتقاء یافته، تحمل بیشتر شرایط اسیدی، و توانایی فعالیت بدون افزودن کلسیم، توسعه یافتهاند که مزایای آشکاری را به صنایع ارائه میدهند (Declerck, 2000). α-آمیلاز ملکول نشاسته را با شکستن اتصالات ∝-دی-(4-1) گلیکوزیدی بهصورت تصادفی با طول مختلف دارای پایانههای کاهنده و ناکاهنده دارای شاخههای اولیگوساکاریدی آبکافت میکند و ∝-دی-(4-1)(6-1) گلوکوزیل اولیگوساکاریدها و در نهایت مالتوز تولید میکنند (شکل 6). معمولاً دو نوع α-آمیلاز وجود دارد، α-آمیلاز تکپارکننده که معمولاً 30 تا 40 درصد نشاسته را حل میکنند و α-آمیلاز دیساکارید کننده است که مشابه β-آمیلاز معمولاً 50 تا 60 درصد نشاسته را تبدیل به دیساکارید میکنند. اکثر α-آمیلازها معمولاً ترکیبی از این دو است (Vihinen, 1989). α-آمیلاز بیشترین عملکرد را در اسیدیته مناسب خود در 6.3 و 6.8 دارد، و در اسیدیته کمتر از 4 و بیشتر از 9 تغییر فعال است. بهعنوان یک پروتئین به گرما حساس است. این آنزیم توان شکستن گلوکز انتهایی باقیمانده با اتصال ∝-دی-(6-1) در آمیلوپکتین در ملکول نشاسته ندارد، از این رو تکههای نشاسته (دکسترین ضعیف) باقی میماند. توضیح اینکه معمولا 20 تا 25 درصد نشاسته آمیلوز به صورت خطی با واحدهای تکرارشونده گلوکز با اتصالات ∝-دی-(4-1) گلیکوزیدی، و 75 تا 80 درصد آن نیز آمیلوپکتین دارای شاخههای گلیکوزیدی با اتصالات ∝-دی-(6-1) گلیکوزیدی است. عموماً در مورد نشاسته دو نوع هیدرولیز وجود دارد: هیدرولیز داخلی و هیدرولیز خارجی. هیدرولیز داخلی در داخل زنجیره مولکولی عمل میکند و منتهی به قندهای گلوگز و مالتوز میشود. درحالی که هیدرولیز خارجی فقط روی پایانههای ناکاهنده انتهایی عمل میکند.
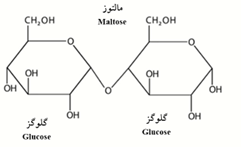
شکل 7-ساختار شیمیایی مالتوز.
β-آمیلاز به ملکول نشاسته در پایانه غیرکاهنده زنجیره بیرونی (متصل به کربن 4) حمله میکند و با حذف گامبهگام واحدهای مالتوز عمل میکند (شکل 7). به دلیل اینکه آن نمیتواند اتصالات ∝-دی-(6-1) را بشکند، یک محصول دوحالته تکههای (4-1)(6-1) گلوکان و قند کاهنده بهدست میآید. گلوکو-آمیلاز نشاسته را به ∝-دی گلوکز بهعنوان واحدهای ساختاری نهایی تجزیه میکند. آنزیم دکستریناز نیز معمولاً پیوندهای 1-6 را در محل شاخهدار شدن آمیلوپکتین مورد آبکافت قرار میدهد (شکل 8). معمولاً تبدیل آنزیمی نشاسته از طریق افزایش دما و ظاهرشدن مرگ آنزیم، یا با افزودن سم آنزیم مثل یونهای مس، جیوه و روی یا معرفهای اکسیدکننده خاتمه مییابد. مقدار 0.1 تا 0.2 درصد معرف غیرفعالکننده بر مبنای وزن نشاسته معمولاً برای این منظور استفاده میشود. همچنین غیرفعالسازی با افزایش اسیدیته با حد بیشتر از محدوده فعالیت آنزیم میتواند انجام شود.
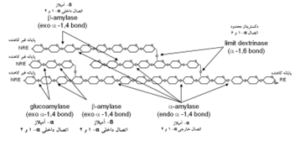
شکل 8- ساختار آمیلوپکتین و جایگاه نقاط هیدرولیز آنزیمی. RE = پایانه کاهنده؛ NRE = پایانه غیر کاهنده (Guerra, 2009).
آنزیم α-آمیلاز برای تبدیلات آنزیمی نشاسته بهوسیله شرکتهای تولیدی مختلف با نامهای تجاری متنوع تولید و به صنایع کاغذسازی فروخته میشوند. آنزیم تولیدی هر تولید کننده، دارای سطح خاصی از قدرت یا استحکام فعالیت آنزیمی است که بر پایه وزنی یا در حالت مایع بر پایه لیتر معرفی میشود.
استفاده از نشاسته در کاغذسازی
حدود 29 درصد کل نشاسته مصرفی در صنایع مختلف، در صنایع کاغذسازی استفاده میشود (Bajpai, 2018). در صنایع کاغذسازی نشاسته در دو بخش تر و خشک قابل استفاده است. استفاده از نشاسته علاوه بر بهبود استحکام (ghofran, 2017; Moradian, 2016; Rezayati Charani, 2018)، تغییرات ابعادی را کاهش میدهد، سفتی را بیشتر میکند، و خصوصیات دیگر ورقه را هم بهبود میدهد. منبع نشاسته مورد استفاده با توجه به سهم آمیلوز به آمیلوپکتین در آن که سبب اختلاف ترکیبات شیمیایی آنها نسبت به هم میشود به دلیل تأثیر بر خصوصیات گرانروی آن هنگام اصلاح و آماده سازی (Liu, 2006; Russell,1987; Zou, 2012)، بر عملکرد نشاسته در آهارزنی کاغذ اثر میگذارد (Brenner,2016). معمولاًٌ برای آهار سطحی استفاده از منابع با آمیلوز بیشتر ارجهیت دارد (Schopke, 2007). اما برای استفاده در پایانه تر جهت بهبود مقاومتهای فیزیکی و مکانیکی زیاد بودن سهم آمیلوپکتین نسبت به آمیلوز در نشاسته، به دلیل اینکه شاخهدار بودن آن، مناسبتر است که به سوسپانسیون غلیظ افزوده میشود (Eriksson, 2005). ضمن اینکه برای استفاده از نشاسته بهعنوان کمکنگهدارنده نرمه، پرکننده و رنگدانه در پایانه تر، نشاسته با درصد آمیلوز بیشتر مناسبتر است که به سوسپانسیون خمیرکاغذ رقیق افزوده میشود. امکان استفاده از انواع نشاسته با توجه به نوع کاربرد در پایانه خشک کاغذسازی به صورت آهارزنی و اندود وجود دارد اما برای پایانه تر به سبب بار آنیونی الیاف خمیرکاغذ عموماً از انواع نشاسته دارای بار کاتیونی در اسیدیته بیشتر از شرایط خنثی و نشاسته آمفوتری برای اسیدیته کمتر از شرایط خنثی نقش کمک نگهدارنده بهتری دارند (de Clerck, 2009)( شکل 9).
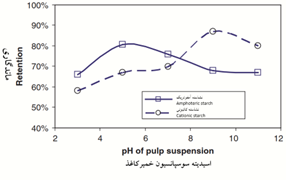
شکل 9- قدرت نگهداري نشاستههاي كاتيوني و آمفوتري در کاغذهای دستساز با تغییر درجه اسیتدیته سوسپانسیون خمیرکاغذ (بر اساس مصرف 2 درصد نشاسته اصلاحشده بر مبنای وزن خشک خمیرکاغذ) (de Clerck, 2009).
انتخاب نشاسته خام و یا نشاسته اصلاحشده عمدتاً بهوسیله گرانروی پراکنش، شکلگیری فیلم و مقاومت به بیاتیشدن کنترل میشود (Bajpai, 2018). انواع متفاوت نشاسته اصلاحنشده، اکسیدشده، نشاسته با اسید وآبسپار شده، نشاسته جانشین شده، نشاسته کاتیونی و آنیونی، نشاسته پیوندخورده، و نشاسته آبگریز برای آهارزنی کاغذ استفاده میشوند. به عنوان مثال، برای محصولات کاغذی با ارزش افزوده زیاد آهار سطحی شده با نشاسته، تغییرات گسترده در کیفیت ذاتی نشاسته اکسیدشده اثر منفی بر ویژگیهای کاغذ خواهد داشت. مضافاًٌ اینکه، برداشت چسب نشاسته توسط ورقه کاغذ وابسته به گرانروی و غلظت نشاسته است. در صورتی که نشاسته دارای گرانروی کم باشد، برداشت نشاسته از طرف سطوح رولها زیاد خواهد شد که نهتنها مصرف نهایی نشاسته را زیاد نمیکند بلکه اثر منفی بر چاپپذیری کاغذ خواهد گذاشت و ماتی آن را کم خواهد نمود.
اصلاح نشاسته برای کاغذسازی
آمادهسازی انواع نشاسته به روش فیزیکی، در واحد کاغذسازی صورت میگیرد. برای آمادهسازی، نشاسته در آب تا دمای حدود 80-98 درجه سانتیگراد حرارت داده میشود و در همان محدوده دما، به مدت 10 تا 20 دقیقه ثابت نگاه داشته میشود. در طی گرم گردن، گرانولهای نشاسته آب را جذب و متورم میشوند، بخشی از آنها حل میشوند، و بخشی دیگر شروع به باز شدن میکنند. درجه باز شدن گرانول و گرانروی چسب نشاسته به منبع نشاسته (شکل 3) و درجه اصلاح، شرایط دما و زمان پخت، و مقدار بهمزدن وابسته میباشد (شکل 10). روش اصلاح نشاسته برای مصرف در آهارزنی درونی با آهارزنی سطحی کاغذ متفاوت است.
شکل 10- تغییرات گرانروی محلول نشاسته با تغییرات دما و زمان، هنگام پخت برای استفاده در آهار سطحی کاغذ (Sulaiman, 2011).
اصلاح نشاسته برای آهارزنی درونی کاغذ
نشاسته خام به طور طبیعی دارای بار منفی در سطح تماس خود با محیط آبی اطراف خود است. به دلیل اینکه الیاف سلولزی نیز به طور طبیعی دارای بار منفی در سطح تماس خود در محیط آبی میباشند، برای استفاده از نشاسته جهت آهار درونی ضرورت دارد بار سطحی نشاسته از محدوده آنیونی به کاتیونی تغییر کند تا بین نشاسته با بار کاتیونی و الیاف سلولزی با بار منفی جاذبه برای جذب به یکدیگر فراهم شود (Anderson, 1992; Ghasemian, 2012). با همین هدف معمولاً در آهارزنی داخلی از انواع نشاستههای کاتیونی استفاده میشود که در محل مصرف ابتدا به روش فیزیکی پخته و بعد به خمیرکاغذ افزوده میشود. معمولاً از نشاسته کاتیونی در پایانه تر بهعنوان کمکنگهدارنده نرمه، پرکنندهها و رنگدانهها روی توری کاغذسازی و نیز بهبود استحکام کاغذ خشک استفاده میشود.
اصلاح نشاسته برای آهارزنی سطحی کاغذ
نشاسته بهعنوان متداولترین چسب در آهار سطحی استفاده می شود (Lipponen, 2005). برای آهارزنی سطحی معمولاً از نشاسته خام به دلیل زیاد بودن گرانروی استفاده نمیشود و برای کاهش گرانروی معمولاً نشاسته را اصلاح میکنند. اصلاح نشاسته برای کاهش گرانروی از طریق کاهش غلظت محلول نشاسته و یا کاهش درجه بسپارش مولکولهای نشاسته امکانپذیر است. در صورت کاهش غلظت نشاسته، اثر آن در صورت استفاده برای آهارزنی کاهش خواهد یافت بنابراین این روش چندان مورد تمایل صنایع نمیباشد. روش دیگر کاهش گرانروی نشاسته کاهش درجه بسپارش آن است تا با حفظ غلظت آن، گرانرویاش کاهش و قابل استفاده در آهار سطحی کاغذ شود. اصلاح نشاسته عمدتاً از طریق آنزیم و اکسید کردن با مواد شیمیایی انجام میشود که در ادامه به معرفی مزایا و محدودیتهای آن اشاره خواهد شد.
مزایا و محدودیتهای انواع نشاستههای اصلاحشده برای کاغذسازی
اکثر کاغذسازان به دلیل عدم دسترسی به نشاسته با کیفیت بهتر، با وجود محدودیتهای کیفی جدی، هنوز از نشاسته اکسیدشده استفاده میکنند. بازده در طول مدت تجزیه اکسیداسیون نشاسته خام هنگام آمادهسازی شیمیایی نشاسته اکسیدی حدود 15 تا 20 درصد کاهش مییابد. این عامل دلیل اولیه برای قیمت بیشتر نشاسته اکسیدشده است. علاوه بر قیمت زیادتر نشاسته اکسیدی، تغییرات گستردهای در کیفیت نشاسته اکسیدی معمولاً وجود دارد که گرانروی آن ممکن است از 45 تا 500 سانتی پوآز (در دمای 50 درجه سانتیگراد و غلظت 5 درصد) تغییر کند (Bajpai, 2018). با وجود این مشکلات جدی، هنوز بسیاری از کاغذسازان به دلیل عدم تأمین نشاسته خام با کیفیت، از نشاسته اکسیدی استفاده میکنند. با دلیل افت 15 تا 20 درصدی در بازده تبدیل شیمیایی نشاسته به روش اکسیدی قیمت آن بیشتر از نشاسته خام است. در مقابل، اصلاح آنزیمی نشاسته برای آهار سطحی کاغذ مقرونبهصرفه است. نشاسته اصلاحشده به روش آنزیمی عمدهترین نشاسته مصرفی در کشورهای توسعهیافته برای آهاردهی سطحی کاغذ است (Bajpai, 2005). زیرا کنترل مناسبتر کیفیت نشاسته از طریق جایگزینی نشاسته اکسیدی با نشاسته اصلاحشده به روش آنزیمی را فراهم میکند.
اصلاح آنزیمی نشاسته برای کاغذسازی
استفاده از آنزیمها برای اصلاح (آبکافت جزئی) نشاسته در محل کارخانه از نظر اقتصادی بهدلیل ارزان بودن، حذف واسطهها و نزدیک بودن به محل مصرف برای صنایع کاغذسازی میتواند به عنوان مزیت نسبت به اصلاح اکسیدی محسوب شود ولی با این حال در مقایسه با سایر روشهای اصلاح نشاسته، نیازمند دقت بیشتر و نظارت دقیقتر نسبت به آمادهسازی آن از نشاسته اصلاحشده و مشتقات آن است. با توجه به اختلاف در عملکرد آنزیمها در واکنش با نشاسته، در اصلاح نشاسته برای کاغذسازی از آنزیمهای خانواده α- آمیلاز استفاده میشود که همانطور که قبلا گفته شد از طریق گسستن پیوندهای ∝-دی – (4-1) گلیکوزیدی موجود در بخش داخلی زنجیره آمیلوز یا آمیلوپکتین سبب اصلاح گرانروی شده و درنتیجه میتوانند مقدار آب لازم و گرانروی مورد نیاز برای ترکیببندی مواد پوششدهی با غلظت مختلف را فراهم کند (Bajpai, 2018). مقدار آنزیم α-آمیلاز مورد نیاز در فرآیند آمادهسازی نشاسته بهوسیله روش وزنی و یا حجمی اندازهگیری میشود. به دلیل توانایی متفاوت α-آنزیمها، در وزن یا حجم یکسان، عملکرد آنزیمها در سیستم آمادهسازی متفاوت است. بنابراین توانایی آنها به منظور محاسبه درصد مصرف α-آنزیم، هنگام تغییر منبع تأمینکننده، تعیین میشود. اگر توانایی تعیین نشود، هنگام تغییر منبع تأمینکننده آنزیم، با وجود استفاده از نشاسته مشابه در فرآیند تبدیل، در گرانروی نهایی نشاسته آماده شده برای استفاده، تغییر رخ میدهد. مقدار مصرف واقعی آنزیم وابسته به نیازهای هر یک از کارخانهها است. مقدار مصرف آنزیم بین 0.001 تا 0.01 درصد بر اساس وزن پایه خشک نشاسته در سیستم آمادهسازی است. بهعنوان یک قانون عمومی، اکثر واحدهای کاغذسازی با مقدار مصرف 0.005 درصد فعالیت میکنند. روشی دیگر برای تعیین مقدار مصرف آنزیم بر پایه تبدیل توانایی آنزیمها با واحد لیکوفن (liquefon) برای هر کیلوگرم نشاسته قلیایی خشک است (Johnston, 1935). هر لیکوفن به مقداری از آنزیم اطلاق میشود که 0.35 میلیگرم ماده نشاسته استاندارد را در شرایط آزمایشگاهی معین در 1 دقیقه تبدیل میکند (Thompson, 1977). اگر ارزش لیکوفن یک آنزیم مشخص باشد، اپراتور میتواند برای اصلاح نشاسته با گرانروی مورد نیاز، وزن یا حجم آنزیم مورد نیاز در سیستم تبدیل-آمادهسازی را محاسبه کند. بر اساس همین گزارش، مقدار مصرف آنزیم بر پایه لیکوفن از 2.000 تا 20.000 لیکوپن بر کیلوگرم نشاسته خشک تغییر میکند. بیشتر کارخانههای کاغذ در محدوده 9000 لیکوفن بر کیلوگرم نشاسته خشک کار میکنند (Maurer, 2001). با مقایسه مقادیر لیکوفن هر آنزیم از دو منبع متفاوت میتوان رابطه توانایی تبدیل نشاسته بین دو آنزیم را نسبت به هم هنگام واکنش آنزیمی برای آمادهسازی نشاسته محاسبه نمود. آبکافت نشاسته با آنزیم برای تنظیم گرانروی علاوه بر وابستگی به مقدار مصرف آنزیم، به مدت واکنش در دامنه دما و اسیدیته معین دوغاب نشاسته نیز وابسته است (Xia, 2007). اکثر آنزیمها در آبکافت نشاسته در اسیدیته در طیف 6-7 و دمای 70-80 درجه سانتیگراد برای پخت (تبدیل) به روش منقطع استفاده میشوند (Yankov, 1986). هنگام تبدیل آنزیمی نشاسته، آبکافت آنزیمی پس از رسیدن به حد معین در گرانروی نشاسته آماده شده، از طریق غیرفعالسازی آنزیم متوقف میشود. آبکافت آنزیمی نشاسته بهعنوان یک فرآیند، در هر اسیدیته و درجه حرارت به کار گرفته شده، وابسته به عوامل مقدار مصرف آنزیم، مدت زمان واکنش، و غلظت نشاسته ژلاتینه بهعنوان سه متغیر فرآیندی اصلی هستند (Soni, 2003). واکنش آمیلاز با نشاسته وقتی شروع میشود که نشاسته به دمای ژلاتینی حدود 70 تا 80 درجه سانتیگراد برسد. در دامنه دمایی کمتر واکنش نسبتاً آرام انجام میشود و منتهی به گرانروی کمی بیشتر از حد پیشبینی شده خواهد شد و در مرحله پایان پخت، با افزایش دما به محدوده 90 تا 100 و ماندگاری در آن به مدت 10 دقیقه فعالیت آنزیم غیرفعال خواهد شد (Kraus, 1993). عموماً نشاسته با غلظت 10 تا 30 درصد مواد جامد با مقدار مشخص آنزیم مصرفی پخته میشود (Chiu, 1990). سپس دوغاب حاصل به سطح مورد نیاز رقیق میشود و برای تیمار کاغذ در پرس آهارزنی استفاده میشود. برای استفاده در پرس آهارزنی سطحی، نشاسته اصلاحشده با آنزیم، با همه عناصر خود در ترکیببندی سوسپانسیون برای آهار زنی کاملاً مخلوط میشود و مورد استفاده قرار میگیرد.
مزایا و محدودیتهای نشاسته اصلاحشده آنزیمی در مقایسه با اکسیدی برای کاغذسازی
نشاسته اصلاحشده به روش شیمیایی مثل نشاسته اکسیدشده به دلیل تشکیل محصولات AOX (Halogenated Organic Compounds (AOX)) (ترکیبات آلی هالژوندار) در اثر واکنش هیپوکلریت سدیم با چربیهای باقیمانده در نشاسته خام میتواند در کاربرد آن برای محصولات مصرفی تاثیر گذارد (Maurer, 2009). اصلاح گرانروی نشاسته با آنزیم، نیازی به مواد شیمیایی ندارد و نشاسته اصلاحشده حاصل کاملاً عاری از محصولات AOX است. اما، اکسیداسیون نشاسته خام با هیپوکلریت سدیم در دمایی نسبتاً کم اتفاق میافتد و نیاز به زمان واکنش طولانیتر است. ضمن اینکه نشاسته خام واکنش انتخابپذیری خوبی ندارد و لذا منتهی به افت به شکل مواد محلول در آب میشود که در نهایت به فاضلاب میرود و در نتیجه نیاز به تیمار جدی دارد که منتهی به افزایش هزینه میشود. از طرفی دیگر، واکنش آنزیمی بسیار انتخابپذیر است و آبکافت دقیقتر میتواند برای اجتناب از تولید هر نوع مواد قابلحل کنترل شود تا گرانروی به میزان دلخواه کاهش یابد. نشاسته اکسیدشده از طریق اصلاح شیمیایی در محل تولید (مبداء) نشاسته انجام میشود. بنابراین کاغذساز در مقصد هیچ کنترلی بر کیفیت آن در رابطه با گرانروی ندارد. آمادهسازی یا پخت نشاسته اکسیدشده در کارخانه کاغذسازی فقط برای پراکنش و ژلهای کردن انجام میشود. در عوض، اصلاح آنزیمی نشاسته بهوسیله کاغذسازان و کارخانه کاغذسازی (مقصد) انجام میشود و همانجا گرانروی نهایی توسط واحد تولیدکاغذ کنترل میشود. عموماً، به دلیل گران بودن نشاسته اکسیدی، آهار سطحی با نشاسته اصلاحشده آنزیمی در مقایسه با استفاده از نشاسته اکسیدشده اقتصادیتر است. به دلیل اینکه نشاسته خام حاوی برخی پروتئینهای باقیمانده است، درجه روشنی آهارزنی کاغذ با نشاسته اصلاحشده با آنزیم مشابه نشاسته خام به طور جزئی کاهش مییابد (Lee, 2002) که میتواند با مصرف معرفهای نوری روشنکننده جبران شود. گاهی اوقات، مشکل رنگ در نشاسته آنزیمی مربوط به حضور فلزات در نشاسته خام است. بنابراین لازم است نشاسته خام مصرفی برای اصلاح آنزیمی، پروتئین و مواد معدنی بسیار کم یا ناچیز داشته باشد. با این وجود، شرایط فرآیندی در خصوص اسیدیته دوغاب نشاسته، پروفیل دما- زمان، مقدار مصرف آنزیم، و مدت واکنش برای کنترل کیفیت اصلاح آنزیمی نشاسته نیاز به دقت بیشتر از شرایط مربوط به نشاسته اکسیدی دارد. در سال 2015 میلادی شرکت استرالیایی فناوریهای جی ام دبیل یو (GAW technologies GmbH) اقدام به بررسی قابلیت استفاده از اصلاح نشاسته با آنزیم α- آمیلاز در محل کارخانه صنایع کاغذ پارس در ایران به منظور جایگزینی اقتصادی برای مصرف نشاسته اکسیدی نمود و پیشنهاد خود را طبق گزارش شماره او 0037020 تحویل مدیریت وقت صنایع کاغذ پارس داد. طبق این گزارش که بر اساس نتایج تحقیقات در صنایع کاغذ پارس تنظیم شده بود، گزارش شد برای بهبود مقدار مشخصی از خواص کاغذ، مقدار مصرف نشاسته اصلاحشده با روش آنزیمی کمتر از نوع اکسیدی خواهد بود و با لحاظ گرانتر بودن نشاسته اکسیدی نسبت به نشاسته خام و قیمت آنزیم مصرفی، با سرمایهگذاری 252 هزار یورویی برای نصب و راهاندازی سیسم استفاده از آنزیم برای اصلاح نشاسته خام بهعنوان جایگزین استفاده از نشاسته اکسیدی، صنایع کاغذ پارس سالانه حدود 911 هزار دلار صرفهجویی خواهد داشت. شرکت GAW گزارش کرده است نصب و راهاندازی تجهیزات استفاده از نشاسته آنزیمی را برای 50 کارخانه در سطح دنیا تاکنون عملیاتی نموده است (Saffarzadeh, 2015).
نتیجهگیری
امروزه ضروری است نشاسته برای بهبود خصوصیات فیزیکی و مکانیکی انواع کاغذ در اکثر صنایع کاغذسازی استفاده شود. با توجه به مزایای فنی و اقتصادی جایگزینی استفاده از نشاسته آنزیمی بر نشاسته اکسیدی انتظار میرود صنایع کاغذسازی کشور برای حفظ قدرت رقابت در بازار به سمت اصلاحاتی در فرآیند استفاده از نشاسته متمایل شوند. با توجه به اینکه در ایران هنوز هیچ گزارشی در خصوص استفاده از نشاسته آنزیمی برای صنایع کاغذسازی منتشر نشده است و از طرفی تقریباً اغلب کارخانههای کوچک و بزرگ کاغذسازی از نشاسته برای آهار سطحی کاغذ با هدف ارتقاء خواص آن استفاده میکنند، در این مقاله تلاش شد اصلاح نشاسته با تأکید بر اصلاح آنزیمی برای کاغذسازی مورد بررسی قرار گیرد و مزایا و محدودیتهای استفاده از اصلاح نشاسته با آنزیم α-آمیلاز برای جایگزینی با نشاسته اکسیدی به محققان مرتبط و صاحبان صنایع کاغذسازی کشور معرفی شود و همچنین درک بیشتری با مباحث اصلاح نشاسته برای مصرف در کاغذسازی برای متخصصان مستقر در صنایع کاغذسازی کشور در صورت تمایل به جایگزینی نشاسته آنزیمی با نشاسته اکسیدی در خط تولید فراهم شود.
منابع
- Anderson, K. R. 1992. Cationic cross-linked starch for wet-end use in papermaking. U.S. Patent 5,122,231.
- Anwunobi, A. P., et al. 2011. Recent applications of natural polymers in nanodrug delivery. J Nanomedic Nanotechnol S, 4(002).
- Bajpai, P. 2018. Enzymatic Modification of Starch for Surface Sizing. In Biotechnology for Pulp and Paper Processing (P. 431-442). Springer, Singapore.
- Bates, F. L., French, D., Rundle, R. E. 1943. Amylose and amylopectin content of starches determined by their iodine complex formation1. Journal of the American Chemical Society, 65(2), P.142-148.
- Brenner, T., et al. 2016. Processing surface sizing starch using oxidation, enzymatic hydrolysis and ultrasonic treatment methods—Preparation and application. Carbohydrate Polymers, 138,P. 273-279.
- Chinga-Carrasco, G., Ehman, N. V., Filgueira, D., Johansson, J., Vallejos, M. E., Felissia, F. E., Håkansson, J., Area, M. C. 2019. Bagasse—A major agro-industrial residue as potential resource for nanocellulose inks for 3D printing of wound dressing devices. Additive Manufacturing, 28, P. 267-274.
- Chiu, C.W. 1990. National Starch and Chemical Investment Holding Corp, Partially debranched starches and enzymatic process for preparing the starches. U.S. Patent 4,971,723.
- Chiu, C. W., Solarek, D. 2009. Modification of starches. In Starch (P. 629-655). Academic Press.
- de Clerck, P. 2009. Starch in the wet-end. In Applications of Wet-End Paper Chemistry (P. 171-194). Springer, Dordrecht.
- Declerck, N., Machius, M., Wiegand, G., Huber, R., Gaillardin, C. 2000. Probing structural determinants specifying high thermostability in Bacillus licheniformis α-amylase. Journal of molecular biology, Vol. 301(4), P.1041-1057.
- Education, C. D. 2014. Mashing: Starch Liquefaction, 10/4/2014 ed. craftdistilleredu.
- Eriksson, M., Pettersson, G., Wågberg, L. 2005. Application of polymeric multilayers of starch onto wood fibres to enhance strength properties of paper. Nordic Pulp and Paper Research Journal, Vol. 20(3), P. 270-275.
- Flórez, J. F., Chamorro, E. M. C., Sandoval, E. R., Salcedo, J. G., Velasquez, H. J. C. 2019. Cassava starches modified by enzymatic biocatalysis: effect of reaction time and drying method. DYNA: revista de la Facultad de Minas. Universidad Nacional de Colombia. Sede Medellín, Vol. 86(208), P. 162-170.
- Florez, J. P., Fazeli, M., Simão, R. A. 2019. Preparation and characterization of thermoplastic starch composite reinforced by plasma-treated poly (hydroxybutyrate) PHB. International journal of biological macromolecules, Vol. 123, P. 609-621.
- Ghasemian, A., Ghaffari, M. Ashori, A. 2012. Strength-enhancing effect of cationic starch on mixed recycled and virgin pulps. Carbohydrate Polymers,Vol. 87, P. 1269-1274.
- Ghofran, R., Moradian, H., Saadatnia, M. A., Rezayati Charani, P. 2017. Application of cellulosic nanofibers to replace with imported long- fiber pulps in paper made from bagasse. Iranian Journal of Wood and Paper Industries, Vol. 7, P. 523-536.
- Gonenc, I., Us, F. 2019. Effect of Glutaraldehyde Crosslinking on Degree of Substitution, Thermal, Structural, and Physicochemical Properties of Corn Starch. Starch‐Stärke, Vol.71(3-4), P. 1800046.
- Guerra, N. P., Torrado-Agrasar, A., López-Macías, C., Martinez-Carballo, E., García-Falcón, S., Simal-Gándara, J., Pastrana-Castro, L. M. Use of amylolytic enzymes in brewing. In Beer in health and disease prevention. Academic Press, Elsevier, King’s College London, London, UK, P: 113-126.
- Hietaniemi, M., Ekman, J., Karppi, A., Kolari, M., Kemira, O. 2019. A method for treating starch in pulp, paper and board making processes. U.S. Patent Application 15/755,591.
- Ibrahim, B. M., Fakhre, N. A. 2019. Crown ether modification of starch for adsorption of heavy metals from synthetic wastewater. International journal of biological macromolecules, Vol. 123, P. 70-80.
- Johnston, W., Jozsa, S. 1935. A general method for determining the concentration of enzyme preparations. J. Am. Chem. Soc., Vol. 57(4), P.701-706.
- Kraus, J. K., Hebeda, R.E. 1993. Method for retarding staling of baked goods. Unilever Bestfoods North America, U.S. Patent 5, 209, 938.
- Lee, H. L., et al. 2002. Surface sizing with cationic starch: Its effect on paper quality and papermaking process. Tappi J., Vol.1(1), P. 34-40.
- Liu, C., Y., et al. 2008. Chemically modified starch reinforced natural rubber composites. Polymer, Vol. 49(8), P. 2176-2181.
- Liu, H., et al. 2006. Gelatinization of cornstarch with different amylose/amylopectin content. Carbohydrate Polymers, Vol.65(3), P. 357-363.
- Lu, D., C., et al. 2009. Starch-based completely biodegradable polymer materials. 3, 366-375.
- Marciniak, G., et al. 1982. A comparative study of the methods for the determination of the activity of bacterial alpha-amylases. 34, 422-430.
- Maurer, H.W. 2001. Starch and starch products in surface sizing and paper coating, Tappi Press, P. 227.
- Maurer, H. W., et al. Opportunities and challenges for starch in the paper industry. Starch‐Stärke, Vol. 50(9), P. 396-402.
- Meimoun, J., et al. 2018. Modification of starch by graft copolymerization. Vol.70, P. 1600351.
- Moradian, M. H., Rezayati Charani, P., Sadatnia, M.A. 2016. Improving paper breaking length using cellulosic nanofibers in bagasse pulp, Vol. 69(3), P. 603-614.
- Nawrath, C., Poirier, Y., Somerville, C. 1995. Plant polymers for biodegradable plastics: cellulose, starch and polyhydroxyalkanoates, Vol. 1, P. 105-122.
- Ojogbo, E. 2019. Starch modification for sustainable and functional material applications. University of Waterloo, P. 127.
- Pandiselvam, R., Manikantan, M. R., Divya, V., Ashokkumar, C., Kaavya, R., Kothakota, A., Ramesh, S. V. 2019. Ozone: An Advanced Oxidation Technology for Starch Modification. Ozone: Science and Engineering, P. 1-17.
- Pérez, S., Baldwin, P. M., Gallant, D. J. 2009. Chapter 5 – Structural Features of Starch Granules I. In: Bemiller, J. & Whistler, R. (eds.) Starch (Third Edition). San Diego: Academic Press, P. 149-192.
- Rajagopalan, G., Krishnan, C. 2008. α-Amylase production from catabolite derepressed Bacillus subtilis KCC103 utilizing sugarcane bagasse hydrolysate. Bioresource technology, Vol. 99(8), P. 3044-3050.
- Rezayati Charani, P., Moradian, M. H., Saadatnia, M. A. 2018. Sequence analysis using cellulose nanofibers, cationic starch and polyacrylamide in the paper tensile strength. Journal of Wood and Forest Science and Technology, Vol. 25, P. 73-82.
- Russell, P. L. 1987. Gelatinisation of starches of different amylose/amylopectin content. A study by differential scanning calorimetry. Journal of Cereal science,Vol. 6(2), P.133-145.
- Saffarzadeh, A. 2015. Rebuilt of enzymatic starch conversion system of Pars Paper industries. RE: GAW technologies GmbH, report number O0037020.
- Sandstedt, R. M., Gates. R. L. 1954. The cereal amylases with reference to flour and malt behavior. Food research, Vol.19, P. 190-195.
- Schirmer, , Jekle, M., Becker, T. 2015. Starch gelatinization and its complexity for analysis. Starch‐Stärke, Vol. 67(1-2), P. 30-41.
- Schopke, H., Servay, T., Meijer, H., Xue, Z., Winter, D. 2007. Amylose Starch Products as Sizing Agents for Textile Yarns. BASF Plant Science GmbH, U.S. Patent Application 10/594,689.
- Soni, S.K., Kaur, A. and Gupta, J.K. 2003. A solid state fermentation based bacterial α-amylase and fungal glucoamylase system and its suitability for the hydrolysis of wheat starch. Process Biochemistry, Vol. 39, P. 185-192.
- Sulaiman, R. 2011. Estimation of kinetic parameters in a corn starch viscosity model at different amylose contents. Michigan State University, P. 233.
- Tanyildizi, M. S., Özer, D., Elibol, M. 2005. Optimization of α-amylase production by Bacillus sp. using response surface methodology. Process Biochemistry, Vol. 40(7)P. 2291-2296.
- Tester, F., Karkalas, J., Qi, X. 2004. Starch—composition, fine structure and architecture, Vol. 39, P. 151-165.
- Tharanathan, R. N. 2005. Starch—value addition by modification. Critical reviews in food science and nutrition, Vol. 45(5), P. 371-384.
- Thompson, K. N., Johnson, R. A., Lloyd, N. E. 1977. Process for producing dextrose using mixed immobilized enzymes. Standard Brands Inc, U.S. Patent 4,011,137.
- Tsuge, H., Tatsumi, E., Ohtani, N., Nakazima, A. 1992. Screening of α‐Amylase Suitable for Evaluating the Degree of Starch Retrogradation. Starch‐Stärke, Vol. 44(1), P. 29-32.
- Van Der Maarel, M. J., Van der Veen, B., Uitdehaag, J. C., Leemhuis, H., Dijkhuizen, L. 2002. Properties and applications of starch-converting enzymes of the α-amylase family. Journal of biotechnology, Vol. 94(2), P. 137-155.
- Planchot, V., Colonna, P., Gallant, D. J., Bouchet, B. 1995. Extensive degradation of native starch granules by alpha-amylase from Aspergillus fumigatus. Journal of Cereal Science, Vol. 21(2), P. 163-171.
- Vihinen, M., Mantsiila, P. 1989. Microbial amylolytic enzyme. Critical reviews in biochemistry and molecular biology, Vol. 24(4), P. 329-418.
- Xia, X.-X., Xue, Y.-K. 2007. A study on the modification of corn starch with enzyme [J]. China Pulp and Paper Industry,Vol. 8.
- Yankov, D., Dobreva, E., Beschkov, V., Emanuilova, E. 1986. Study of optimum conditions and kinetics of starch hydrolysis by means of thermostable α-amylase. Enzyme and microbial technology, Vol. 8, P. 665-667.
- Ye, J., Luo, S., Huang, A., Chen, J., Liu, C., McClements, D. J. 2019. Synthesis and characterization of citric acid esterified rice starch by reactive extrusion: A new method of producing resistant starch. Food hydrocolloids, Vol. 92, P. 135-142.
- Young, A. 1984. Fractionation of Starch’in Starch Chemistry and Technology (2nd edn)(Whistler, RL., BeMiller, JN and Paschell, EF, eds. Academic Press. P. 249-284.
- Zou, W., Yu, L., Liu, X., Chen, L., Zhang, X., Qiao, D., Zhang, R. 2012. Effects of amylose/amylopectin ratio on starch-based superabsorbent polymers. Carbohydrate polymers, Vol. 87(2), P. 1583-1588.









